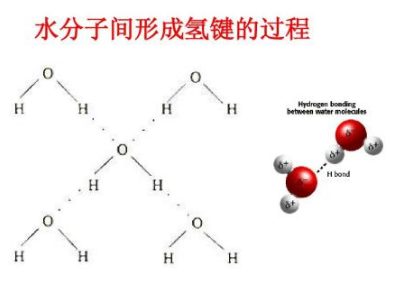
氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O F N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键。
氢键既可以是分子间氢键,也可以是分子内的。其键能最大约为200kJ/mol,一般为5-30kJ/mol,比一般的共价键、离没扮子键和金属键键能要小,但强于静电引力。
氢键对于生物高分子具有尤其重要的意义,它是蛋白质和核酸的二、漏察运三和四级结构得以稳定的部分原因。
扩展资料
氢键的分类
一、分子间氢键
分子间有氢键的液体,一般粘度较大。例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为粘稠状液体。熔点、沸点分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的熔点、沸点高。
二、对称氢键
通常氢是通过共价键与X原子相连,并通过较长和较弱的“氢链”与Y原子连接,即使X与Y是相同的元素,X-H和H…Y距离也往往不相等。但在M+HA2−型的酸式盐中,其中A是F−或某些有机酸(如乙酸和苯甲酸),氢原子恰好处于X和Y原子的中心(X-H…Y)。这一类例子被称作对称氢键,它们往往键能较大,键长较短。
对称氢键和不对称氢键的现象往往难以解释。一个比较认同的解释是,将FHF−离子中的氢键看成氢桥,类似于乙硼烷中的BHB硼桥键。只不过硼桥键是三中心两电子键,而氢桥键是三中心四电子键。
三、双氢键
1995年以来,报道了许多种分子间存在一种被称为双氢键的新型分子间力,可用通式AH…HB表示。双氢键的键长一般小于220pm,极限可能为270pm,键能从n~n*10kJ/mol不等,相当于传统分子间力能量数量级。
双氢键的一些例子包括:BH4−…HCN、BH4−…CH4、LiH…NH4、LiH…HCN、LiH…HC≡CH,CH4…H-NH3+和H-Be-H…H-NH3等,其中以BH4−…HCN双氢键的键长为最短(171pm),键能也最返梁高(75.44kJ/mol),远大于水和HF间的氢键键能。目前对双氢键的研究还不是很深入。
参考资料来源:百度百科-氢键
标签:氢键,作用