阴极反应:2Cl-(氯离子)-2e=Cl2↑(氯气)
阳极反应:2H+(氢离子)+2e=H2↑(氢气)
总反应:2NaCl+2H2O===2NaOH+H2↑+Cl2↑(反应条件为电解)
在阳极氯离子被氧化生成氯气,在阴极氢离子被还原生成氢气,因为氢离子被消耗促进水的电离产生更多的氢氧根,故可看作生成了NaOH.工业中用阳离子交换膜将阴阳极隔开防止氢气和氯气接触反应,阴极区生成NaOH。
物化性质
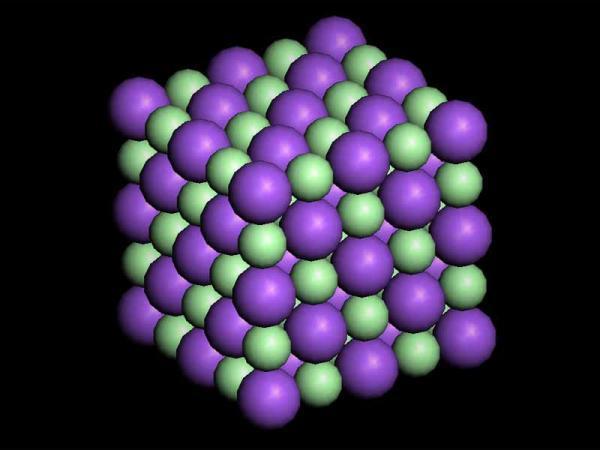
NaCl,食盐和石盐的主要成分,离子型化合物。无色透明的立方晶体,熔点为801℃,沸点为1413℃,相对密度为2.165。有咸味,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性。
主要用途
无机和有机工业用作制造氯气、氢气、盐酸、纯碱、烧碱、氯酸盐、次氯酸盐、漂白粉、金属钠的原料、冷冻系统的致冷剂,有机合成的原料和盐析药剂。钢铁工业用作热处理剂。高度精制的氯化钠用作生理盐水。食品工业、日常生活中,用于调味等。
高温热源中与氯化钾、氯化钡等配成盐浴,可作为加热介质,使温度维持在820~960℃间。此外、还用于玻璃、染料、冶金等工业。
参考资料:百度百科 nacl
标签:NaCl,方程式,电解